
Siang sobat bangkusekolah.com. Masih ingat dengan hukum-hukum dasar kimia? Sebelum kita belajar lebih dalam lagi ilmu kimia, ada baiknya jika kita memahami lebih dalam lagi hukum-hukum dasar kimia.
Pada artikel sebelumnya, kita sudah pernah membahas Hukum Kekekalan Massa dan Hukum Perbandingan Tetap. Nah, kali ini kami akan menjelaskan pada sobat semua apa yang dimaksud dengan Hukum Perbandingan Berganda, Hukum Perbandingan Volume, dan Hukum Avogadro. Hukum-hukum dasar kimia inilah yang nantinya akan kita gunakan ketika kita mengenal lebih jauh lagi ilmu-ilmu kimia.
Hukum Perbandingan Berganda, Hukum Perbandingan Volume dan Hukum Avogadro
1. Hukum Perbandingan Berganda
Hukum dasar kimia yang satu ini berkaitan erat dengan masalah perbandingan. Jika sebelumnya kita sudah pernah membahas mengenai Hukum Perbandingan Tetap, kali ini yang akan kita jelaskan adalah Hukum Perbandingan Berganda.
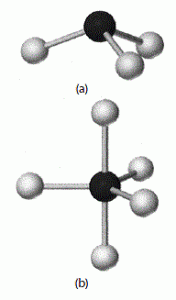
Salah seorang pakar kimia, Dalton menyebutkan bahwa Hukum Perbandingan Berganda berlaku apabila dua macam unsur membentuk sebuah senyawa lebih dari satu yang mana massa salah satu unsurnya berbanding secara kelipatan bilangan bulat serta sederhana.
Contoh misalnya, Fosfor serta klorin bisa membentu dua buah macam senyawa. Senyawa yang pertama fosfor X : 2g bereaksi dengan klorin 6,9g. Dan senyawa yang kedua fosfor Y : 2g bereaksi dengan oksigen 11,5g. Lantas bagaimana rumus pada kedua senyawa tersebut?
Perbandingan massa pada kedua senyawa tersebut (massa fosfor yang sama) ialah 6,9 : 11,5 atau 3 : 5. Dapat disimpulkan bahwa rumus senyawa X serta Y ialah PCl3 serta PCl5. Bentuk stukturnya bisa kita lihat pada gambar di bawah ini.
2. Hukum Perbandingan Volume
Ilmuwan pertama yang menjelaskan mengenai Hukum Perbandingan Volume ialah Joseph Louis Gay-Lussac. Dalam percobaan yang ia lakukan, ia mencoba mereaksikan antara senyawa H2 dan O2 mengalami kondisi yang tetap. Pada setiap percobaan yang ia lakukan, volume senyawa H2 yang ia gunakan memiliki variabel yang tetap. Sedangkan untuk volume senyawa O2 memiliki variabel yang bebas, serta dilakukan percobaan pada kondisi yang sebaliknya yakni volume H2 variabel bebas, dan volume O2 variabel tetap.
Dari percobaan diatas, dapat disimpulkan jika persamaan reaksi yang terjadi pada kedua senyawa tersebut adalah 2 H2(g) + O2(g) → 2 H2O(g)
Dari situ kita bisa mentabulasikannya dalam bentuk tabel sebagai berikut.
Tabel pengamatan volume H2 tetap
|
Volume H2 mL |
Volume O2 mL |
Volume H2O mL |
| 20 | 5 | 10 |
| 20 | 10 | 20 |
| 20 | 15 | 20 |
| 20 | 20 | 20 |
Tabel pengamatan volume O2 tetap
|
Volume H2 mL |
Volume O2 mL |
Volume H2O mL |
| 10 | 10 | 10 |
| 15 | 10 | 15 |
| 20 | 10 | 20 |
| 25 | 10 | 20 |
Ketika volume dari O2 10 mL, maka volume dari H2O tidak akan berubah yakni 20 mL. Begitu pula dengan percobaan II, yang mana volume dari H2O tidak akan berubah yakni tetap 20 mL setelah volume dari H2 telah mencapai 20 mL dengan volume O2 = 10 mL. Dapat disimpulkan bahwa perbandingan volume dari reaksi dua senyawa H2 serta O2 adalah 20 mL gas H2 + 10 mL gas O2 →20 mL H2O
3. Hukum Avogadro
Siapa sih sebenarnya Avogadro? Sobat bangkusekolah.com tercinta, Avogadro adalah satu dari sekian banyak pakar kimia yang ada. Ia berasal dari negeri Italia. Ia menyebutkan bahwa ada hubungan antara jumlah partikel-partikel gas serta volume dari gas yang sama sekali tidak tergantung akan jenis gas. Hipotesis yang terkenal darinya ialah Pada suhu serta tekanan yang sama, volume gas yang sama mengandung molekul dengan jumlah yang sama.
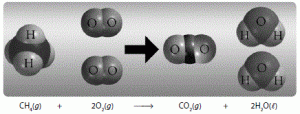
Hipotesis ini dapat diartikan bahwa di suhu serta tekanan yang sama, gas-gas yang bereaksi dengan perbandingan volume menunjukkan perbandingan antar molekulnya. Salah satu contoh misalnya reaksi antara gas N2 seta gas O2 akan menghasilkan gas baru NO2 dengan penjelasan sebagai berikut.
– 1 N2 + 2 O2 → 2 NO2
– 1 N2 + 2 O2 → 2 NO2
– n N2 + 2n O2 → 2n NO2
Dari penjelasan diatas dapat kita simpulkan bahwa reaksi diukur pada suhu serta tekanan sama dengan jumlah molekul O2 bereaksi 2x jumlah dari molekul N2 dan jumlah yang dihasilkan dari molekul NO2 adalah 2x dari jumlah molekul N2 atau bisa diakatakan memiliki jumlah molekul O2 yang sama.



Be the first to comment