Hai teman-teman bangku sekolah. Dalam belajar ilmu kimia kita pasti mengenal Sistem Periodik Unsur. Nah, para ahli tentu saja tidak serta merta menciptakan sistem tersebut. Mereka membutuhkan waktu dan usaha yang panjang untuk mengelompokkan unsur unsur yang sudah ditemukan sehingga menjadi sistem periodik unsur yang kita kenal sekarang.
 Kali ini, kita akan belajar bersama tentang sejarah para ahli mengelompokkan unsur-unsur yang sudah ditemukan.
Kali ini, kita akan belajar bersama tentang sejarah para ahli mengelompokkan unsur-unsur yang sudah ditemukan.
Perkembangan Sistem Periodik Unsur
A. Pengelompokan unsur menurut Lavoiser:
Antoni Lavoiser mengelompokkan 33 unsur kimia yang dibagi menjadi 4 kelompok, yaitu:
- gas : cahaya,kalor,oksigen,nitrogen dan oksigen
- tanah : kapur,magnesium oksida,barium oksida, alumunium oksida dan silikon oksida
- logam : antimon, perak, arsenik, bismuth, kobalt, tembaga, timah, besi, mangan, raksa, molibdenum, nikel, emas, platina, tobel, tungsten dan seng
- non logam : sulfur, fosfor, karbon, asam klorida, asam florida dan asam boraks.
Kelemahan teori Lavoisier :
Pengelompokan masih terlalu umum
Kelebihan dari teori Lavoisier :
Sudah mengelompokan 33 unsur yang ada berdasarkan sifat kimia sehingga bisa di jadikan referensi bagi ilmuan-ilmuan setelahnya.
B. Hukum Triade Dobereiner
Dobereiner mengelompokkan unsur berdasarkan kemiripan sifat-sifatnya yang berhubugan dengan massa atom. Setiap tiga unsur yang sifatnya mirip massa atom (Ar) unsur yang kedua (tengah) merupakan massa atom rata-rata dari massa atom unsur pertama dan ketiga.
Contoh:
- Cl, Br dan I
- Ca, Sr dan Ba
- S, Se dan Te
Dobereiner menyimpulkan bahwa unsur-unsur dapat di kelompokan ke dalam kelompok-kelompok tiga unsur yang di sebut triade.
Kelemahan dari teori triade:
Pengelompokan unsur ini kurang efisien dengan adanya beberapa unsur lain dan tidak termasuk dalam kelompok triade padahal sifatnya sama dengan unsur dalam kelompok triade tersebut.
Kelebihan dari teori triade:
Adanya keteraturan setiap unsur yang sifatnya mirip massa Atom (Ar) unsur yang kedua (tengah) merupakan massa atom rata-rata di massa atom unsur pertama dan ketiga.
C. Hukum Oktaf Newlands
Unsur-unsur yang disusun berdasarkan urutan kenaikan massa atomnya mempunyai sifat yang akan berulang tiap unsur kedelapan. Artinya unsur pertama mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan dan begitu seterusnya sehingga disebut hukum oktaf. Newlands baru menemukan 60 unsur dan belum ada gas mulia. Terdapat dua unsur yang ditempatkan sama karena kemiripan sifatnya. Pengelompokan unsur berdasarkan hukum oktaf Newlands.
Kelebihan hukum Oktaf Newlands:
Dibandingkan dengan triade Dobereiner, yaitu lebih banyak unsur-unsur yang digolongkan.
Kelemahannya:
Pada unsur-unsur yang massanya cukup besar (>40), pengulangan sifat unsur tidak terjadi lagi.
D. Sistem Periodik Mendeleyev
Mendeleyev mengurutkan unsur berdasarkan kenaikan massa atom dan sifat kimianya. Apabila unsur disusun menurut massa atomnya, maka unsur tersebut akan menunjukkan sifat yang sama secara periodik.
Keunggulan :
- Ada tempat bagi unsur transisi
- Terdapat tempat-tempat kosong yang diramalkan akan diisi dengan unsur yang belum ditemukan pada waktu itu
Kelemahan :
Adanya empat pasal anomali, yaitu penyimpangan terhadap hukum perioditas yang disusun berdasarkan kenaikan massa atomnya. Yaitu Ar-K, Te-I, Co-Ni, Th-Pa
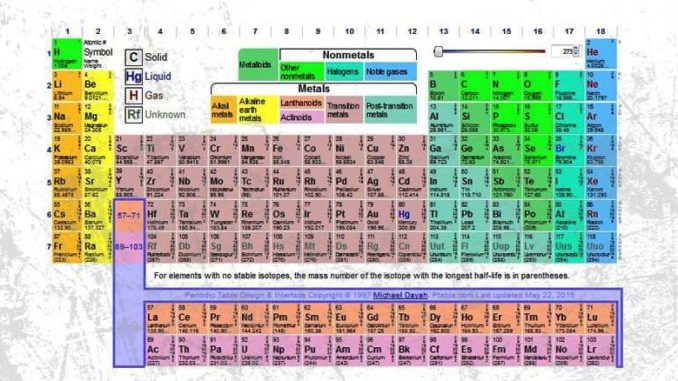
E. Sistem Periodik Modern Henry G.Moseley
Karena disusun dalam bentuk panjang maka sering disebut dengan tabel periodik panjang. Sistem Periodik Modern adalah Sistem Periodik yang digunakan sampai saat ini dan merupakan penyempurnaan dari sistem periodik Mendeleyev
Pada tabel periodik ini dikenal istilah periode dan golongan. Golongan disusun berdasarkan jumlah elektron valensi. Unsur dalam 1 golongan memiliki sifat yang cenderung sama dan ditempatkan pada 1 kolom. Periode untuk menunjukkan kelompok unsur yang memiliki jumlah unsur sama. Sistem Periodik Modern terdiri dari 18 Golongan dan 7 periode.
Kelebihan dari teori ini adalah Moseley menemukan bahwa sifat-sifat unsur merupakan sifat periodik dari nomor atomnya. Sehingga tabel periodik bentuk pendek dikembangkan menjadi tabel periodik bentuk panjang, yang kemudian disempurnakan menjadi tabel periodik modern yang disahkan penggunaannnya oleh IUPAC.
Demikianlah sahabat pembahasan tentang perkembangan sistem periodik unsur. Semoga bermanfaat bagi sahabat bangkusekolah. Jangan lupa di share dan di komen ya. Terima kasih..

Be the first to comment